Ciclo do nitrogênio e suas reações
O nitrogênio, dentre os macronutrientes, é o mais exigido pelas plantas. É componente de aminoácidos, proteínas e material genético (DNA e RNA). Está associado também ao crescimento e desenvolvimento dos vegetais, por estar envolvido no processo de síntese de clorofilas, responsáveis pelo processo fotossintético.
Na atmosfera, o nitrogênio está presente na forma de gás nitrogênio, representado pela fórmula molecular N2 (N≡N), e constitui 78 % do ar atmosférico. Apesar de ser encontrado em grande quantidade na atmosfera, o gás nitrogênio não é utilizado pela maioria dos organismos vivos, os quais são incapazes de fixar e incorporar à matéria viva o nitrogênio atmosférico. Entre os organismos capazes de utilizar esse nitrogênio, estão alguns tipos de bactérias (SANTOS, 2020).
Na litosfera, camada do planeta representada pela crosta terrestre, encontra-se cerca de 98 % do nitrogênio existente, onde parte está nos oceanos, parte compondo rochas e solo. Especificamente no solo, o nitrogênio encontra-se quase que em sua totalidade (cerca de 98 %) na forma orgânica, e a outra parte encontra-se nas formas minerais de amônio (NH4+), nitrito (NO2–) e nitrato (NO3–).
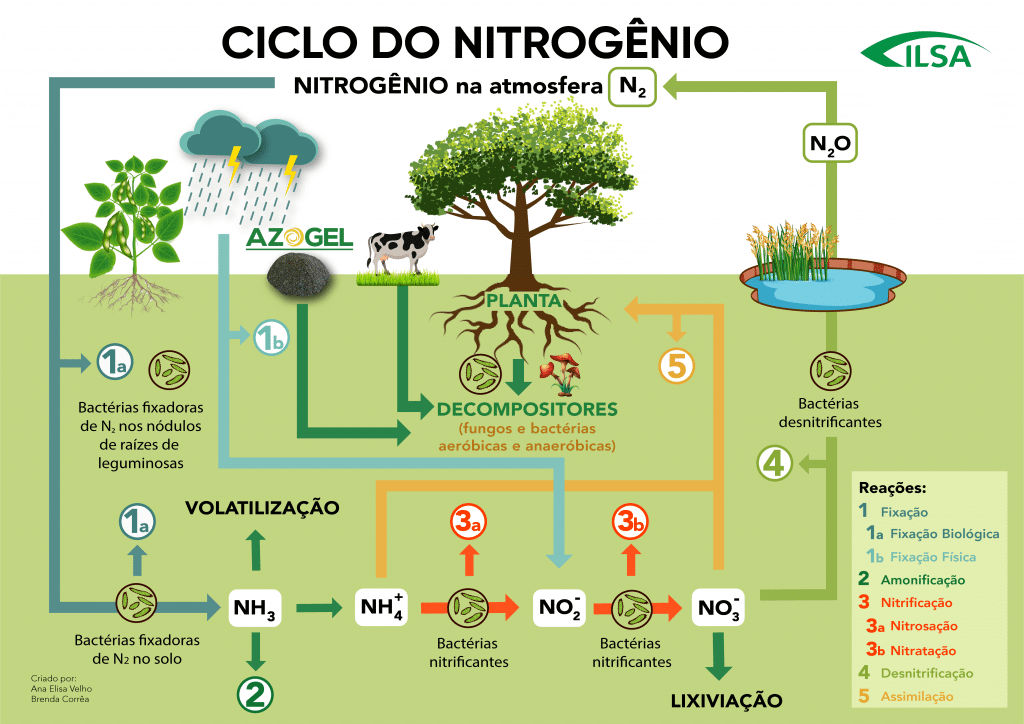
O ciclo do nitrogênio permite a ciclagem deste elemento no ambiente, disponibilizando-o para os seres vivos e, após, ao meio novamente. Este ciclo compreende cinco etapas específicas: fixação (1), amonificação (2), nitrificação (3), desnitrificação (4) e assimilação (5) que serão descritas a seguir.
1 – Fixação do Nitrogênio
O processo de fixação do nitrogênio pode ocorrer de três formas: fixação biológica, fixação física e fixação industrial, descritas em seguida.
a. Fixação Biológica
A primeira etapa do ciclo do nitrogênio, a fixação biológica, ocorre através de um processo enzimático, onde o nitrogênio atmosférico (N2) é reduzido à amônia (NH3), por intermédio da ação de microrganismos de vida livre, simbióticos ou associados aos vegetais, como mostra a equação química abaixo:
N2 + 8e– +8H++16ATP → Nitrogenase → 2NH3 +H2 +16ADP+16Pi
De acordo com Vieira (2017), o problema que envolve a fixação do nitrogênio atmosférico está relacionado à presença da ligação covalente tripla entre as moléculas, o que torna este gás altamente estável em temperatura ambiente. O rompimento desta tripla ligação pelos microrganismos requer a presença da enzima nitrogenase.
Os microrganismos fixadores de N2 podem existir como organismos de vida livre e em associações com diferentes graus de complexidade com as plantas. Estes microrganismos podem ser divididos em: 1. Fixadores não-simbióticos ou de vida livre; 2. Fixadores associativos, que formam uma relação casual e pobremente estruturada com raízes ou porções aéreas das plantas; e 3. Fixadores simbióticos que fixam o N2 em associações organizadas com plantas superiores (VIEIRA, 2017).
Dentre os fixadores simbióticos, existem alguns gêneros de bactérias que se destacam por sua eficiência e especificidade com plantas leguminosas, os chamados rizóbios, tais como: Rhizobium, Sinorhizobium (Ensifer), Mesorhizobium, Azorhizobium e Bradyrhizobium. Para que a simbiose ocorra de maneira ideal, alguns fatores são determinantes, como disponibilidade de nutrientes (fósforo, cobalto, molibdênio, níquel), pH do solo (se baixo, pode inibir a ação das bactérias), temperatura e regime hídrico adequado.
b. Fixação Física
Vale salientar que existe também a fixação física do nitrogênio, onde o N atmosférico (N≡N ou N2) transforma-se em amônio por intermédio de fenômenos físicos, como relâmpagos, cuja elevada energia separa as moléculas de nitrogênio e permite que os seus átomos se liguem com moléculas de oxigênio existentes no ar, formando óxidos de nitrogênio, sobretudo o nitrato (NO3–). Estes são posteriormente dissolvidos na água da chuva e depositados no solo.
c. Fixação Industrial
Sob alta temperatura e pressão, ocorre a ligação entre nitrogênio e hidrogênio, formando a amônia (NH3). Este processo é conhecido como Haber-Bosch, ponto de partida para a fabricação de diversos produtos para agricultura e indústria.
2 – Amonificação
Após a fixação, ocorre a etapa de amonificação, onde o nitrogênio orgânico, na forma de amônia (NH3) é mineralizado em amônio (NH4+) através de ação enzimática e na presença de água. A forma amônia é insolúvel em água e altamente tóxica aos tecidos vegetais. Neste processo atuam microrganismos tanto aeróbios como anaeróbios, exclusivamente heterotróficos, que utilizam a matéria orgânica como fonte de energia. Equação química do processo de amonificação:
NH3 + H2O → NH4+ + OH–
A fertilização nitrogenada é uma complementação à capacidade de suprimento de nitrogênio dos solos, a partir da mineralização de seus estoques de matéria orgânica, geralmente alta em relação às necessidades das plantas (MESSIAS et al., 2008). Ainda de acordo com estes autores, é habitual classificar os fertilizantes nitrogenados em orgânicos e químicos, em função de sua forma de atuação e das condições gerais de emprego.
Messias et al. (2008), sugere que os fertilizantes nitrogenados minerais são divididos em quatro grupos: amoniacais, nítricos, nítrico-amoniacais e amídicos. Já os nitrogenados orgânicos são provenientes da mineralização dos resíduos vegetais e animais, através da ação efetiva da microbiota do solo (MESSIAS et al., 2008).
A ureia, amplamente utilizada na agricultura, é um fertilizante químico do tipo amídico e, quando aplicada, é rapidamente hidrolisada através de um processo bacteriano que utiliza a enzima urease. Com isto, ocorre a imediata disponibilização do nitrogênio o que, do ponto de vista edáfico e fisiológico, não é interessante, já que a liberação imediata potencializa perdas por lixiviação e até mesmo por volatilização.
Desta forma, o uso de fertilizantes orgânicos com matrizes de aminoácidos tendem a ser melhor aproveitados, já que a liberação ocorre de forma gradual, minimizando perdas e disponibilizando o nitrogênio ao longo de todo o ciclo produtivo.
De maneira geral, o processo de amonificação pode ser influenciado pelas condições edafoclimáticas, como: umidade, aeração, temperatura e pH. Além disto, por se tratar de um processo biológico, também pode ser diretamente afetado pelas atividades microbianas do solo.
3 – Nitrificação
A nitrificação consiste na oxidação do amônio (NH4+) a nitrato (NO3–), onde as bactérias nitrificantes utilizam a amônia como fonte de energia e o dióxido de carbono (CO2) como fonte de carbono (NANES, 2017). Este processo ocorre apenas na presença de oxigênio, por ser realizado por bactérias aeróbias. Esta etapa se divide em duas partes, como demonstram as equações químicas a seguir:
2NH3 + 3O2 → 2H+ + 2NO2– + 2H2O + energia (eq. a)
2NO2– + O2 → 2NO3– + energia (eq. b)
A equação “a” corresponde ao processo de nitrosação, que ocorre através da ação de bactérias do gênero Nitrosomonas. Neste momento transcorre a formação do nitrito, que será oxidado a nitrato na equação “b”, chamada de nitratação, realizada por espécies do gênero Nitrobacter. De acordo com Vieira (2017), as bactérias que participam da nitrificação utilizam compostos nitrogenados como fonte de energia e CO2 como fonte de carbono, que necessitam de O2 nos seus processos metabólicos e possuem crescimento muito lento.
Dentre os fatores que afetam positiva ou negativamente o processo de nitrificação, temos a aeração do solo, visto que as bactérias responsáveis por esta etapa são aeróbias; temperatura (ideal entre 26 ºC e 32 ºC); umidade do solo; calagem e a utilização de fertilizantes.
As relações C/N também influenciam diretamente o processo de nitrificação. Segundo Victoria et al. (1992), quando elevadas, causam imobilização de N mineral, pelo menos temporariamente, cessando a nitrificação por falta de substrato e podendo causar deficiência de nitrogênio aos vegetais. De acordo com Moreira e Siqueira (2006), em um solo que oferece condições favoráveis à nitrificação, o nível de nitrato encontra-se razoavelmente alto, enquanto a relação C/N do solo, baixa. Ainda de acordo com estes autores, quando se adiciona quantidade elevada de resíduos orgânicos com alta relação C/N, os microrganismos que atuam na decomposição da matéria orgânica se tornam altamente ativos, produzindo grandes quantidades de CO2, o que faz com que o nitrato e o amônio praticamente desapareçam do solo.
4 – Desnitrificação
Segundo Victoria et al. (1992), a desnitrificação biológica e a volatilização da amônia correspondem as mais importantes perdas gasosas de nitrogênio do solo.
O processo de desnitrificação corresponde à retirada de compostos oxigenados que estão ligados ao nitrogênio, devolvendo-o na forma gasosa à atmosfera e completando o ciclo biogeoquímico deste elemento. Esta etapa só é possível através da ação de microrganismos anaeróbios do solo que, ao realizarem sua respiração, utilizam o nitrato e compostos de carbono como fonte de energia, liberando assim o N gasoso à atmosfera. A reação química é descrita a seguir:
5C2H6O + 12NO3– + 12 H+ → 10CO2 + 21H2O + 6N2(g)
No processo de formação de N2 podem ser formados alguns subprodutos como o óxido nitroso (N2O) e o óxido nítrico (NO) (NANES, 2017). Estes gases são altamente tóxicos, e contribuem para o aquecimento global e destruição da camada de ozônio. De acordo com Bortoli et al. (2012), a emissão de N2O possui potencial de efeito estufa 300 vezes maior em comparação com o CO2, sendo atualmente o terceiro mais importante gás de efeito estufa presente na atmosfera, atrás somente do CO2 (dióxido de carbono) e do CH4 (metano).
As principais variáveis que afetam o processo de desnitrificação na natureza são: a concentração de nitrato e nitrito, o teor de matéria orgânica, a presença de oxigênio dissolvido, a faixa de valores de pH e a temperatura. Desses fatores, a concentração de nitrato endógeno presente na água é um dos principais fatores limitantes do processo (CHAVES et al., 2003).
5 – Assimilação pela planta
Os elementos presentes na solução do solo são absorvidos pelas plantas através das raízes. A assimilação do nitrogênio pela planta se dá pelas formas minerais de NH4+ (amônio) e NO3– (nitrato).
Adubação nitrogenada, o que aplicar?
Entre os principais produtos da ILSA Brasil, encontra-se o Azoslow, fertilizante organomineral peletizado, que é proveniente de tecnologia italiana e tem como principal característica uma formulação que promove liberação gradual de nitrogênio mediada pela ação dos microrganismos, oriunda do Azogel (matriz orgânica exclusiva da ILSA) em associação com a ureia. O Azoslow apresenta 29% de nitrogênio total em sua composição, além do alto teor de carbono orgânico e CTC. Esta alta concentração de carbono orgânico contribui efetivamente no aumento de atividade microbiana do solo próximo à área de aplicação do fertilizante.
A utilização deste organomineral reduz o número de aplicações de nitrogênio, por sua liberação gradual, garantindo assim a disponibilidade deste mineral por mais tempo no solo, o que permite maior economia, menor utilização de máquinas, equipamentos e mão de obra, como já foi comprovado por pesquisas científicas no Brasil. Além disso, estimula o desenvolvimento das raízes, permitindo que as plantas explorem uma maior área de solo em busca de água e nutrientes, elevando a produtividade e rentabilidade por hectare.
Autores
- Eng. Agr. MSc. Aline Tramontini dos Santos
- Eng. Agr. Ana Elisa Velho
- Eng. Agr. MSc. Thiago Stella de Freitas
Referências bibliográficas
BORTOLI, M. et al. Emissão de óxido nitroso nos processos de remoção biológica de nitrogênio de efluentes. Engenharia Sanitária e Ambiental, Rio de Janeiro, v. 17, n. 1, p. 01-06, 2012.
CHAVES, R.A., ABE, D.S., TUNDISI, J.G., MATSUMURA-TUNDISI, T. Fatores controladores da desnitrificação na coluna de água na represa velha do Cepta/Ibama, Pirassununga, São Paulo. Boletim Técnico e Científico – CEPNOR, Belém, v.3, n.1, p. 197-213, 2003.
MESSIAS, A.S. et al. Recomendações de adubação – Fertilizantes, PE, p. 83-103, 2008.
MOREIRA, F.M.S.; SIQUEIRA, J.O. Microbiologia e bioquímica do solo, Editora UFLA, Lavras, 2006. 729 p.
NANES, M.B. Influência da amônia livre na nitrificação parcial em reatores em série anaeróbio e aeróbio. Universidade Federal de Pernambuco (UFPE), Recife. 2017, 83 p. (Dissertação)
SANTOS, V. S. dos. “Ciclo do Nitrogênio”; Brasil Escola. Disponível em: https://brasilescola.uol.com.br/biologia/ciclo-nitrogenio.htm. Acesso em 19 de setembro de 2020.
VICTORIA, R.L., et al. Microbiologia do Solo (cap. 08), Sociedade Brasileira de Ciência do Solo, Campinas, 1992, 360 p.
VIEIRA, R.F. Ciclo do nitrogênio em sistemas agrícolas. Embrapa, Brasília, 2017. 163p.